Newsletter No.20 2023 May
Special Column - 뇌종양 침윤 대식세포의 특성 및 면역 치료

 김현진, 이흥규 (KAIST 의과학대학원)
김현진, 이흥규 (KAIST 의과학대학원)
종양에 대한 연구가 시작된 이래로 환자의 생존과 삶의 질 개선을 위해 다양한 치료법들이 시도되었다. 빠르게 분열하는 암세포를 대상으로 한 화학요법 및 방사선 치료법과 종양의 특수성을 겨냥한 약물들이 개발되었고 면역학적 이해를 토대로 면역세포를 이용하는 면역치료법이 개발되었다. 면역관문 치료제와 같은 최신 방법들은 다양한 환자들에게서 효과를 보고 있지만 종양의 종류 및 특성에 따라 효과가 천차만별이며 뇌종양에서는 유의미한 효과를 나타내지 못했고, 이는 아직도 뇌종양 내 면역환경에 대한 우리의 이해가 충분하지 못함을 의미한다. 기존에 종양 내 대식세포가 면역반응을 억제한다고 알려진 것과 달리, 최근의 연구들은 종양 내 대식세포의 다양성과 이 세포들이 항암면역반응에 관여함을 보고하였고, 특히 대식세포가 많이 유입되는 뇌종양에서는 그들의 기능이 더욱 중요할 것으로 생각된다[1-3]. 이번 뉴스레터에서는 뇌종양 내 면역환경에서 대식세포의 특성과 이를 대상으로 하는 면역치료에 대해 알아보고자 한다.
1. 교모세포종의 면역환경
척추동물의 뇌는 신경계의 중추가 되는 기관으로, 단단한 머리뼈로 외부의 충격으로부터 보호되며 경막과 지주막, 연막으로 구성된 세 겹의 뇌수막으로 둘러싸여 있다. 뇌는 많은 열량을 소모하기 때문에 영양과 산소 공급을 위해 많은 혈관이 발달해 있지만, 물질의 출입을 억제하는 혈관-뇌 장벽이 있어 외부로부터의 독성물질 유입이 효과적으로 차단된다. 뇌는 면역 특권기관으로도 잘 알려져 있는데, 혈관-뇌 장벽이 면역세포의 유입 역시 차단하기 때문에 과도한 면역반응으로 인한 뇌의 손상을 방지할 수 있다. 이 때문에 아직 혈관-뇌 장벽이 완성되기 전인 개체의 발생 단계에 뇌로 유입되는 소교세포는 성체가 되어서도 유지되지만 다른 면역세포의 유입은 극히 제한된다. 면역이 억제된 뇌의 특성은 일반적인 상황에서 중추신경계를 보호하는데 효과적이지만, 종양이 발생할 경우에는 면역세포 및 항암치료제의 유입 역시 차단하기 때문에 효과적인 뇌종양 치료법 개발에 어려움을 주는 요인 중 하나이다. 이러한 면역학적 특성 때문인지, 뇌에서 발생하는 종양은 다른 조직의 종양과는 다른 면역환경을 가지고 있다.
항암면역반응은 1) 종양조직에서 유래된 항원을 항원제시세포가 획득한 뒤 2) 림프절로 이동하여 항원 특이적인 T세포를 활성화시키고, 3) 활성화된 T세포가 종양조직으로 이동하여 종양세포를 공격하는 방식으로 나타난다[4]. 종양 특이적인 CD8 T 세포 반응은 종양을 사멸시키는 주된 반응이며, 최근 시도되는 다양한 면역치료제 역시 CD8 T 세포의 활성 증가를 목적으로 개발되었다. 하지만 교모세포종은 다른 조직의 종양에 비해 T세포의 유입 및 활성이 매우 낮고 면역억제성 대식세포가 많이 유입되는 특징적인 면역환경을 보이며, 이러한 면역환경은 뇌종양에 대한 다양한 치료법이 효과를 나타내지 못하는 중요한 요인으로 생각되고 있다[5].
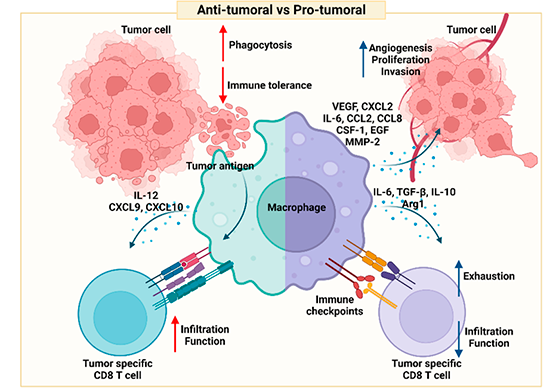 그림 1. 뇌종양 내 대식세포의 종양 억제 및 종양 촉진 기능
그림 1. 뇌종양 내 대식세포의 종양 억제 및 종양 촉진 기능
2. 교모세포종에서 종양 내 대식세포의 작용
일반적인 면역반응에서 대식세포는 표현형에 따라 크게 M1과 M2 대식세포로 나눌 수 있다. M1 대식세포는 염증성 사이토카인과 활성산소종을 만들고 박테리아와 같은 병원체에 대한 면역반응을 나타내며, 이들의 작용은 조직의 손상을 야기할 수 있다. 반면 M2 대식세포는 면역억제성 사이토카인을 만들고 죽은 세포나 병원체를 제거하며 손상된 조직의 재생을 촉진한다. 종양 내 대식세포는 종양세포에서 분비되는 사이토카인이나 종양 내 대사환경 등의 영향을 받아 대부분 면역을 억제하는 M2 대식세포와 유사하게 분극화(polarization) 된다고 알려져 있다. 정상 조직에서는 이러한 대식세포가 분비하는 다양한 성장인자와 효소들이 조직의 재생 및 회복을 촉진하지만, 종양에서는 암세포의 세포분열을 촉진하고 세포 외 기질을 분해하여 암세포의 이동을 용이하게 하여 종양이 주변조직으로 침윤하거나 전이하는데 도움을 준다. 하지만 종양 내에서 일부 대식세포는 림프구에서 분비되는 염증성 사이토카인의 영향을 받아 M1 대식세포와 유사하게 분극화 되기도 하며, 이러한 대식세포는 포식작용을 통해 암세포를 제거하거나 항원제시, 사이토카인 및 케모카인 분비 등을 통해 다른 면역세포의 활성 및 종양 내 유입을 촉진하여 항암면역반응을 일으키는 작용을 하기도 한다.
1) 대식세포에 의한 종양 촉진
대식세포와 함께 배양된 뇌종양 세포는 더 빨리 분열하고 항암제에 의해 유도되는 세포사멸에 저항성을 나타내며 조직 침윤 특성이 증가된다. 대식세포가 분비하는 matrix metalloproteinase-2 (MMP-2)는 세포 외 기질을 분해하여 조직 내 종양세포의 이동을 증가시킴으로써 정상 조직으로의 종양세포의 침윤을 촉진할 뿐 아니라 종양세포의 세포분열 역시 촉진시킨다. 대식세포가 만드는 IL-6와 같은 사이토카인이나 CCL2, CCL8 등의 케모카인 및 CSF-1, EGF 등의 성장인자 역시 종양세포의 조직 침윤성과 세포분열을 증가시켜 뇌종양을 악화시킨다. 이렇게 빠르게 분열하는 종양세포는 그만큼 많은 산소 및 영양분 소모를 충당하기 위해 주변에 새로운 혈관을 만들고, 새로 만들어진 혈관은 종양의 성장을 촉진한다. 뇌종양에서 분리된 대식세포는 VEGF와 CXCL2와 같은 혈관 신생 촉진인자를 분비하며, 뇌종양 내 대식세포를 제거하면 종양 내 혈관 신생이 감소하는 것이 보고되었다[6, 7].
종양 내 대식세포는 종양 성장을 도울 뿐 아니라 종양에 대한 면역반응을 억제한다. 종양 미세환경에서 M2와 유사하게 분화된 대식세포가 분비하는 사이토카인(IL-6, TGF-β, IL-10)이나 억제성 수용체의 리간드(PD-L1, VISTA)는 직접적으로 T세포에 의한 면역반응을 억제하고, Arg1, IDO1/2 등의 효소는 종양 내 면역세포의 활성에 필요한 아미노산을 고갈시킨다[8]. 교모세포종 환자의 데이터에서는 종양 내 대식세포의 유입이 높을수록 예후가 좋지 않다는 것을 보여주며, 마우스 교모세포종 모델에서도 대식세포 유입이 높은 마우스 그룹에서 생존기간이 더 짧고 종양 내 대식세포 유입을 차단하면 마우스의 생존기간이 증가한다[9].
2) 대식세포에 의한 종양 억제
대식세포는 손상된 세포에서 발생하는 DAMP(damage associated molecular pattern)를 인식하는 다양한 수용체를 발현하고 있어 손상되거나 종양이 발생한 조직을 인식할 수 있으며, 이러한 조직에 유입된 대식세포에 의해 만들어지는 사이토카인과 케모카인은 다른 면역세포의 유입 및 활성에 중요하게 작용한다. 특히 anti-PD-1이나 anti-CTLA4 therapy와 같은 면역관문 치료제는 대식세포가 발현하는 IL-12와 CXCL9, CXCL10가 없는 경우 효과가 크게 감소된다는 것이 보고되었다[1, 2].
이름에서 알 수 있듯이 포식작용은 대식세포의 가장 특징적인 기능이다. 대식세포는 세포 표면의 수용체를 통해 감염된 세포나 이상이 생긴 세포를 인식할 수 있고, 다양한 스캐빈저 수용체를 통해 대상을 포식한다. 뇌종양 세포의 경우 정상 뇌세포에 비해 세포막인 인지질이나 막단백질의 glycosylation에 변화가 생기며, 이는 대식세포의 lectin-like receptor에 의해 인식된다. 또한 종양 내에서 apoptosis가 진행되는 암세포의 표면에는 phosphatidylserine이 증가하며 이 또한 대식세포의 스캐빈저 수용체에 의해 인식된다. Apoptosis 된 암세포는 면역 관용을 유도하기 때문에, 대식세포에 의한 이들의 제거는 종양 내 면역환경 조절에도 중요하게 작용한다[10].
수지상세포의 항원제시에 비해 중요성이 덜 알려져 있지만, 대식세포 역시 항원제시를 통해 종양 특이적인 T세포 반응을 일으킬 수 있다. 대식세포의 포식작용은 직접적으로 종양세포를 제거하기도 하지만 항원제시를 위한 종양항원을 획득하는 과정이기도 하다. 대식세포는 상대적으로 TCR과 결합력이 낮은 항원을 제시하는 것으로 보고되었는데, 이는 종양항원을 인식하는 TCR repertoire의 다양성이 증가함을 의미한다[11]. 교모세포종의 경우 돌연변이에 의해 생성되는 종양연관 신생항원(tumor associated neoantigen)이 적어 강한 T세포 반응을 유발하지 못하는 것이 T세포 활성화를 통한 면역치료가 효과를 나타내지 못하는 요인 중 하나로 손꼽히기 때문에, 대식세포의 항원제시를 통해 유발되는 다양한 종양 특이적인 T세포 반응이 이를 해소할 수 있을 것으로 기대된다.
3. 대식세포의 특성을 이용한 면역치료법
현재까지 밝혀진 뇌종양 내 대식세포의 특성을 토대로, 마우스 모델에서 종양 내 대식세포를 줄여 대식세포에 의한 종양 촉진 환경을 개선하려는 시도들이 보고되었다. CCL2/CCR2 나 osteopontin/αvβ5 integrin 등 대식세포의 종양 침윤에 중요한 케모카인-수용체 결합을 방해하는 항체 혹은 억제제의 사용은 뇌종양 내 대식세포의 유입을 효과적으로 억제하였다[12, 13]. 면역억제성 대식세포가 많이 발현하는 CD73에 대한 항체를 처리하여 해당 세포를 제거할 경우에도 생존개선이 나타났으며 anti-PD-1이나 anti-CTLA4 therapy의 효과가 증가되었다[14]. 또한 M2 대식세포를 재분극화 하여 면역반응을 활성화시키는 방법도 시도되었다. CSF-1 수용체 억제제인 BLZ945를 처리할 경우 대식세포 유입에는 큰 차이가 없었지만 대식세포의 M2 분극화를 감소시켰으며 방사선치료나 anti-PD-1 therapy와의 병용에서 치료 효과를 증가시켰다[15]. 또한 대식세포의 SIRPα에 결합해 종양세포에 대한 포식작용을 억제하는 CD47에 대한 anti-CD47 항체는 종양의 성장을 효과적으로 억제했으며, TMZ나 방사선 치료와 병용하면 뇌종양세포에 대한 포식작용과 더불어 항원제시를 통한 종양 특이적인 T세포 반응도 증가시켰다[16].
이러한 결과들을 토대로 임상에서도 뇌종양 내 대식세포를 대상으로 하는 치료법이 시도되고 있다. Anti-CSF-1R 항체나 CSF-1R의 세포 내 신호전달 물질인 STAT3에 대한 억제제나 GM-CSF 등 종양의 특성을 변화시키는 약물과, CXCR4 억제제와 MIF 억제제 등 대식세포의 종양 내 유입을 감소시키는 약물의 단독 투여 혹은 면역관문치료제 및 TMZ+방사선 치료와의 병용요법에 대한 임상시험이 진행되고 있다. anti-CD47을 사용한 종양 치료는 대장암과 혈액암에서 임상시험이 진행중이지만 뇌종양에 대한 임상실험은 시도되지 않았는데, anti-CD47 항체가 혈액학적 이상반응을 나타냈기 때문에 임상에서의 사용을 위해서는 약재의 개선이 필요하다.
- Saha, D., R.L. Martuza, and S.D. Rabkin, Macrophage Polarization Contributes to Glioblastoma Eradication by Combination Immunovirotherapy and Immune Checkpoint Blockade. Cancer Cell, 2017. 32(2): p. 253-267 e5.
- House, I.G., et al., Macrophage-Derived CXCL9 and CXCL10 Are Required for Antitumor Immune Responses Following Immune Checkpoint Blockade. Clin Cancer Res, 2020. 26(2): p. 487-504.
- Kim, H.J., et al., Blood monocyte-derived CD169(+) macrophages contribute to antitumor immunity against glioblastoma. Nat Commun, 2022. 13(1): p. 6211.
- Chen, D.S. and I. Mellman, Oncology meets immunology: the cancer-immunity cycle. Immunity, 2013. 39(1): p. 1-10.
- Thorsson, V., et al., The Immune Landscape of Cancer. Immunity, 2018. 48(4): p. 812-830 e14.
- Wang, G., et al., Tumor-associated microglia and macrophages in glioblastoma: From basic insights to therapeutic opportunities. Front Immunol, 2022. 13: p. 964898.
- Wu, M., et al., Macrophages in Glioblastoma Development and Therapy: A Double-Edged Sword. Life (Basel), 2022. 12(8).
- Mantovani, A., et al., Tumour-associated macrophages as treatment targets in oncology. Nat Rev Clin Oncol, 2017. 14(7): p. 399-416.
- Chen, Z., et al., Cellular and Molecular Identity of Tumor-Associated Macrophages in Glioblastoma. Cancer Res, 2017. 77(9): p. 2266-2278.
- Aminin, D. and Y.M. Wang, Macrophages as a "weapon" in anticancer cellular immunotherapy. Kaohsiung J Med Sci, 2021. 37(9): p. 749-758.
- Bernhard, C.A., et al., CD169+ macrophages are sufficient for priming of CTLs with specificities left out by cross-priming dendritic cells. Proc Natl Acad Sci U S A, 2015. 112(17): p. 5461-6.
- Takenaka, M.C., et al., Control of tumor-associated macrophages and T cells in glioblastoma via AHR and CD39. Nat Neurosci, 2019. 22(5): p. 729-740.
- Wei, J., et al., Osteopontin mediates glioblastoma-associated macrophage infiltration and is a potential therapeutic target. J Clin Invest, 2019. 129(1): p. 137-149.
- Goswami, S., et al., Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma. Nat Med, 2020. 26(1): p. 39-46.
- Pyonteck, S.M., et al., CSF-1R inhibition alters macrophage polarization and blocks glioma progression. Nat Med, 2013. 19(10): p. 1264-72.
- Gholamin, S., et al., Irradiation or temozolomide chemotherapy enhances anti-CD47 treatment of glioblastoma. Innate Immun, 2020. 26(2): p. 130-137.

 학회 홈페이지
학회 홈페이지 뉴스레터 메인
뉴스레터 메인