Newsletter No.20 2023 May
Short Review
IL13Rα2‑targeted third‑generation CAR‑T cells with CD28 transmembrane domain mediate the best anti‑glioblastoma efficacy
 도윤식 (국립암센터)
도윤식 (국립암센터)
Chimeric antigen receptor (CAR)-modifed T (CAR-T) 세포 요법은 암 치료에 강력한 도구로 입증되었지만, 고형 종양의 경우 현재까지는 한계가 분명합니다. 따라서 치료 효과를 개선하기 위해 CAR의 구조를 지속적으로 최적화하는 것이 필요합니다.
본 연구에서 저자는 동일한 single-chain variable fragment (scFv)를 가지지만 CD4, CD8 또는 CD28 (IL13-CD4TM-28.BB.ζ, IL13-CD8TM-28.BB.ζ 및 IL13-CD28TM-28.BB.ζ)의 다른 transmembrane domains (TMD)을 가지는 IL13Rα2를 표적으로 하는 세 가지 다른 3세대 CAR를 생성했습니다. CAR는 retroviruses를 사용하여 원래 T 세포로 전달되었습니다. CAR-T 세포의 anti-GBM 효과는 in vitro에서는 flow cytometry 및 real-time cell analysis 통해 확인하였고 추가로 두 개의 이종이식 마우스 모델에서 확인되었습니다. anti-GBM 활성과 관련되어 차별적으로 발현된 유전자는 high throughput RNA 시퀀싱을 통해 확인되었습니다.
위 세 가지 CAR-T 세포가 IL13Rα2를 더 많이 발현하는 U373 세포와 공동 배양(co-culture)할 때 유사한 항종양 활성을 보이지만 IL13Rα2를 덜 발현하는 U251 세포와 공동 배양할 때는 차이나는 항종양 활성을 나타내는 것을 확인하였습니다. 세 가지 CAR-T 세포 그룹 모두 U373 세포에 의해 활성화될 수 있지만 U251 세포와 공동 배양하였을 때는 IL13-CD28TM-28.BB.ζ CAR-T 세포만 활성화되어 IFN-γ가 증가했습니다. 아울러, IL13-CD28TM-28.BB.ζ CAR-T 세포는 종양 이종이식 마우스 모델에서 가장 우수한 항종양 활성을 나타냈습니다.
본 연구는 IL13-CD28TM-28.BB.ζ CAR-T 세포가 다른 CAR-T 세포보다 IL13Rα2를 발현하는 종양을 표적으로 하는데 더 효과적이라고 결론지었습니다. 이는 IL13-CD28TM-28.BB.ζ CAR-T 세포에서 세포 활성화, 증식 및 이동과 관련된 유전자의 차등 발현 때문인 것으로 보입니다. 이러한 발견은 IL13Rα2를 발현하는 종양 환자에게 IL13-CD28TM-28.BB.ζ CAR-T 세포가 유망한 치료 옵션이 될 수 있음을 시사합니다. (https://doi.org/10.1007/s00262-023-03423-5)
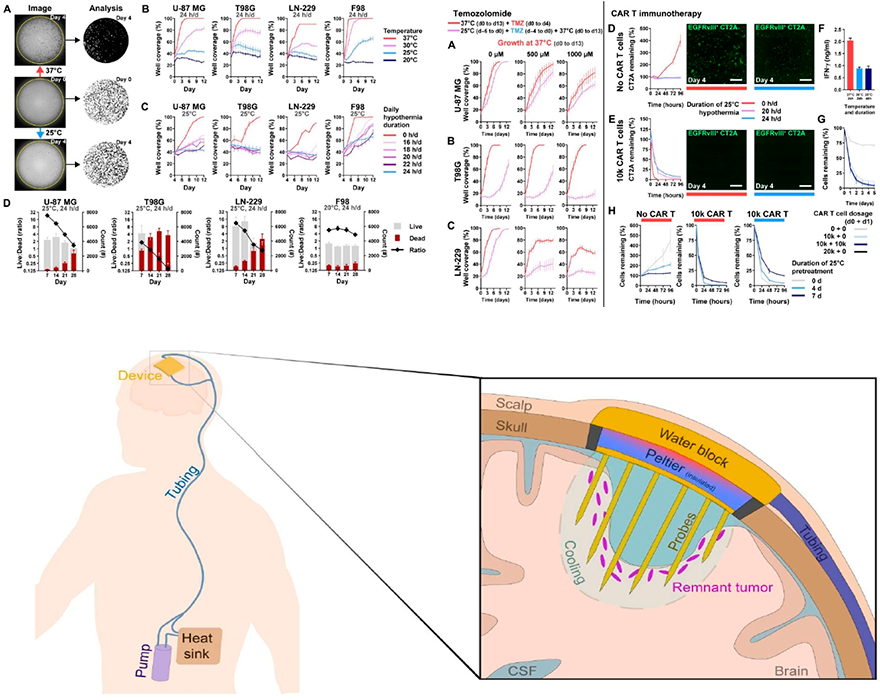
Cytostatic hypothermia and its impact on glioblastoma and survival
 김경민 (인하대병원)
김경민 (인하대병원)
Glioblastoma (GBM)에 대한 새로운 치료법 개발의 일환으로 electric fields, topographical guidance, temperature를 활용한 연구가 진행되고 있다. 이 중 temperature를 활용한 hypothermia therapy는 비교적 덜 연구된 분야로서 크게 cryogenic (freezing)과 non-cryogenic (cytostatic) therapy로 나눌 수 있다. Cryogenic therapy는 종양 세포를 0℃ 미만으로 얼려서 세포를 사멸시키는 것으로 cryosurgery 라고도 일컬어 지는데 시행 과정 중 정상 조직에도 직접적인 손상을 줄 수 있기에 제한점이 크다. 반면 우리 뇌는 moderate hypothermia (32℃~35℃)에서 brain protective effect를 나타내며 cell metabolism, oxygen & glucose consumption이 감소되어 brain cortical injury가 발생하지 않는 특징을 갖는다. 본 논문은 이러한 개념에 착안하여 non-cryogenic hypothermia를 glioblastoma에 적용한 연구이다. 먼저 In vitro에서 3개의 human GBM cell과 1개의 rat GBM cell line에 대해서 각각 20℃, 25℃, 30℃, 37℃에서 cell growth를 억제시키는 hypothermia 적정 온도 25℃를 확인하고 이를 토대로 in vivo 실험을 통해서 25℃ hypothermia가 종양 세포의 성장을 억제하며 chemotherapy (temozolomide)나 immunotherapy (chimeric antigen receptor T cell)와 함께 시행했을 때에도 효과가 있음을 확인하였다. 이를 토대로 수술 후 silent한 remnant tumor의 성장을 억제할 수 있는 implantable hypothermia device 모형을 제시하였는데 현실성 측면에서 이러한 device가 실제로 재현될 수 있을지는 검증이 더 필요하겠지만, 교모세포종의 예후 향상을 도모할 수 있는 새로운 치료 option에 대한 개념을 in vitro, in vivo에서 확인하고 제시했다는 점에서 의미가 있는 논문이다.
https://www.science.org/doi/10.1126/sciadv.abq4882
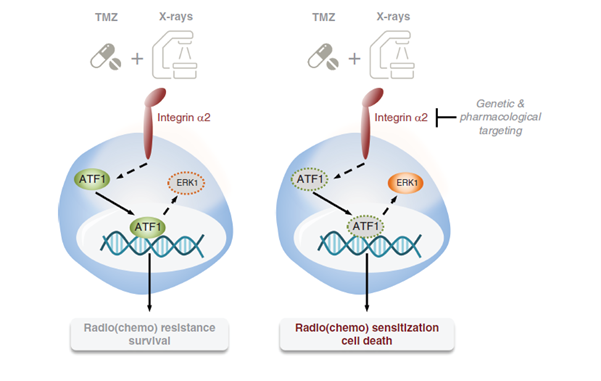
Targeting integrin α2 as potential strategy for radiochemosensitization of glioblastoma
 나민균 (한양대병원)
나민균 (한양대병원)
교모세포종치료에 있어서 여러가지 요인에 의해서 치료 저항생이 생기고 예후에 안좋은 영향을 미치게 되는데, 종양세포와 세포외기질 (ECM, extracellular matrix)의 상호작용은 이러한 방사선 및 항암치료에 대한 치료 저항성에 중심적인 역할을 합니다. Adhesion 수용체인 integrin α2는 정상세포와 비교하여 교모세포종에 더 높게 표현 (expression)되 있는 것은 알려져 있습니다. 이 연구에서는 이런 integrin α2의 차단이 transcription factor인 ATF1의 활성도를 낮추고 이는 방사선 및 항암치료 저항성을 낮추고 치료효과를 올린다는 것을 증명하였습니다. 또한, 동물실험을 통해 integrin α2의 차단이 종양세포 성장을 억제하고 생존율을 올리는 것을 확인했습니다. 이 결과를 토대로 integrin α2 inhibitor의 개발이 이루어 지고 추가적인 연구를 통해 표준치료의 효과를 향상시키는 보조치료제로 사용되어 교모세포종 치료에 도움이 되기를 기원합니다.
(https://doi.org/10.1093/neuonc/noac237)

 학회 홈페이지
학회 홈페이지 뉴스레터 메인
뉴스레터 메인